11月16日,同濟大學生命科學與技術學院、附屬第一婦嬰保健院教授毛志勇團隊和同濟大學生命科學與技術學院、附屬東方醫院教授魏珂團隊在美國《國家科學院院刊》發表論文,揭示了早衰小鼠心肌中DNA雙鏈斷裂修復的異常介導器官功能退化機制,為靶向干預心肌萎縮提供了潛在靶點通路和極具臨床價值的候選方案。
兒童早衰癥是種罕見的衰老加速疾病,患者平均壽命約14.5年,心血管疾病是其致死的主要原因。然而,兒童早衰癥患者心臟的病變機制尚不明確,當前也缺乏有效治療手段。
研究表明,DNA損傷積累與衰老發生關系密切。與其他早衰癥類似,早衰癥患者細胞存在明顯的基因組不穩定特征。然而,兒童早衰癥相關DNA損傷的來源及其如何導致心臟病變的產生等問題仍有待回答。
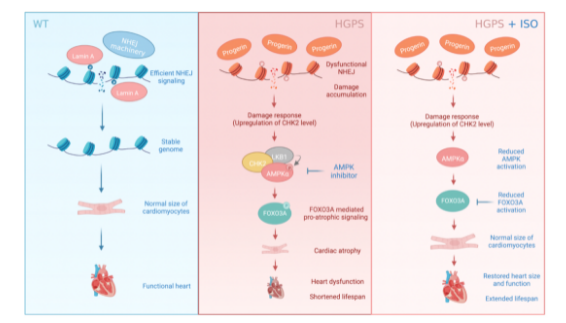
小鼠心肌萎縮機制與干預模式圖。同濟大學供圖
該研究發現,早衰的小鼠心臟及心肌細胞變小,心臟功能顯著下降,呈現心肌萎縮的表型。數據分析發現早衰的小鼠心臟發育、細胞尺寸等通路基因的表達顯著改變。此外,DNA損傷應答相關基因的表達水平在早衰小鼠心臟中亦存在顯著變化。基于此,團隊成員決定聚焦早衰小鼠心臟的DNA修復調控開展研究。
此前的研究中,團隊已在細胞和小鼠水平上開發了多種DNA修復的定量報告系統。然而,由于成年小鼠心肌細胞分離、體外培養及轉染存在較大難度,如何在體內利用報告系統定量研究心臟中的DNA修復成為亟待解決的技術難點。
為此,團隊成員基于已有研究基礎,建立了一種新的DNA修復體內報告模型,實現了心肌中DNA修復的高效在體檢測。利用該模型,研究人員發現早衰小鼠模型的心肌細胞中存在嚴重DNA雙鏈斷裂積累及基因組不穩定現象,這來源于雙鏈斷裂修復通路中非同源末端連接通路修復能力的顯著降低。進一步研究發現,早衰小鼠心臟中出現了一種損傷應答上游激酶的表達提升與激活。進一步的機制研究發現:該激酶導致下游轉錄因子激活,最終介導了心肌萎縮的發生。
研究團隊用異丙腎上腺素(ISO)誘導動物模型的病理性心肌肥大與心力衰竭,對早衰小鼠進行為期兩周的間斷性ISO給藥,可促進早衰小鼠心臟的肥大性生長,使原本呈萎縮表型的心臟回復到與野生型小鼠相當的尺寸。值得注意的是,ISO處理還明顯改善了早衰小鼠的心功能,并顯著延長了早衰鼠的存活時間。
該研究揭示了早衰小鼠心肌中DNA雙鏈斷裂修復的異常介導器官功能退化的分子機制,為靶向干預心肌萎縮提供了潛在靶點通路和極具臨床價值的候選方案。




 17312606166
17312606166