聽說,憋氣30秒,可以鑒定你的肺是否健康。
快來檢測一下!現(xiàn)在,開始憋氣,直到圓點(diǎn)從A點(diǎn)抵達(dá)B點(diǎn)。
(圖片來自網(wǎng)絡(luò))
什么?沒有堅持到30秒!
那我很遺憾的告訴您,這個結(jié)果并不能真實(shí)反映您的肺部健康狀況(頂鍋跑)~只能說明,您的肺活量較小,是不是好久沒運(yùn)動啦?
雖然這一測試無法判定肺的健康狀況,但你是否感受到了呼吸的重要性。每時每刻,新鮮的空氣正通過氣管進(jìn)入溫暖的胸腔,其中的氧氣從肺中濾出,隨著血液奔向大腦,四肢…
今天,我們便來介紹下人體呼吸中樞——肺,主要包括它的結(jié)構(gòu),細(xì)胞類型,相關(guān)重大疾病及動物模型。
肺的生理結(jié)構(gòu)
正常的肺呈淺紅色,位于胸腔,覆蓋在心臟之上。左右胸腔各有肺葉,左二右三,右肺可以分為上、中、下三葉,左肺則僅有上、下兩葉,所以人體的肺一共有五葉。每個肺葉之間有胸膜隔開,各自有支氣管與主氣管相通,彼此之間沒有聯(lián)系。
每次呼吸,空氣通過鼻腔進(jìn)入氣管,再進(jìn)入支氣管。支氣管分為左右主干支氣管,其組成與氣管相似,并逐漸分枝成更小的分支——?dú)夤苤夤軜洌瑢ξ氲目諝膺M(jìn)行引導(dǎo)、加濕和加熱。終末支氣管最后形成小肺泡簇,肺泡總數(shù)達(dá)到數(shù)百萬。肺泡被毛細(xì)血管網(wǎng)所包圍。通過毛細(xì)血管的薄膜,空氣和血液進(jìn)行氧氣和二氧化碳的交換[1]。
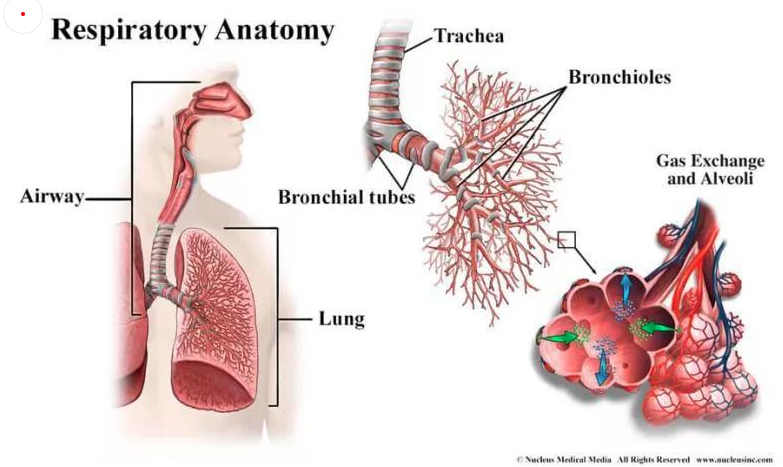
圖1 呼吸系統(tǒng)示意圖(引自https://www.nhlbi.nih.gov/health-topics/how-lungs-work)
肺的細(xì)胞分型
肺部細(xì)胞是肺執(zhí)行生理功能的基本單位,通過了解其種類和狀態(tài),人們可以進(jìn)一步研究肺部疾病的發(fā)生機(jī)理,進(jìn)行精確有效的治療。通過顯微鏡觀察,免疫熒光標(biāo)記等傳統(tǒng)方法,已知曉的人體肺部細(xì)胞類型有45種。而科學(xué)家借助剛剛興起的單細(xì)胞測序技術(shù),從另一個維度繪制出人體更多的肺部細(xì)胞種類及表達(dá)狀態(tài),確定了成人肺中有58種轉(zhuǎn)錄上不同的細(xì)胞群體,包括15種上皮細(xì)胞,9種內(nèi)皮細(xì)胞,9種基質(zhì)細(xì)胞(圖2)和25種免疫細(xì)胞(圖3)[2]。
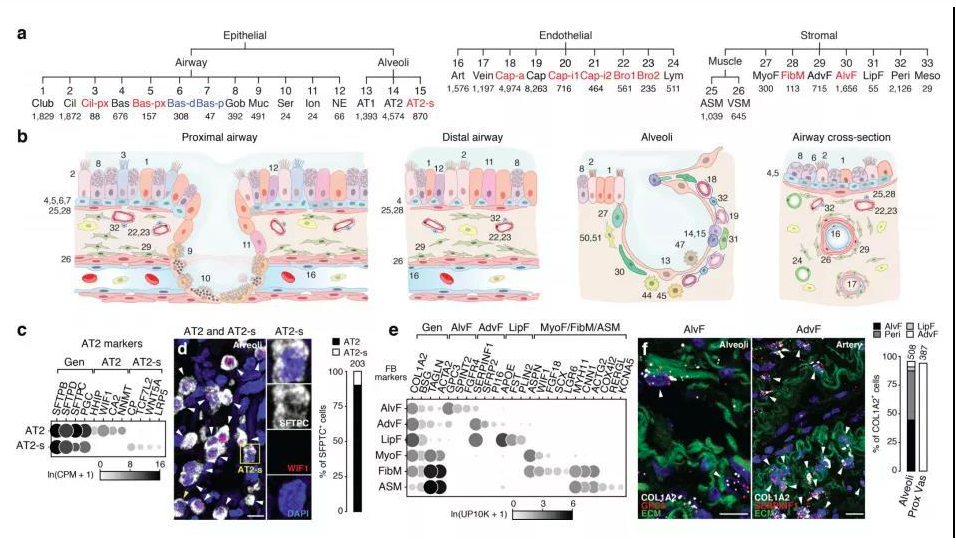
圖2 肺部上皮細(xì)胞、內(nèi)皮細(xì)胞和基質(zhì)細(xì)胞群分類及組織學(xué)定位[2]
而歸納出的這58種細(xì)胞中包含41種已知的肺部細(xì)胞類群,不包含原本被認(rèn)為存在的4種細(xì)胞,即神經(jīng)元、神經(jīng)膠質(zhì),簇狀細(xì)胞以及嗜酸粒細(xì)胞。對該研究結(jié)果感興趣的小伙伴可以在公眾號中索要原文。下面將挑選兩大類含量最多的肺部細(xì)胞(上皮細(xì)胞和內(nèi)皮細(xì)胞)做簡要介紹。
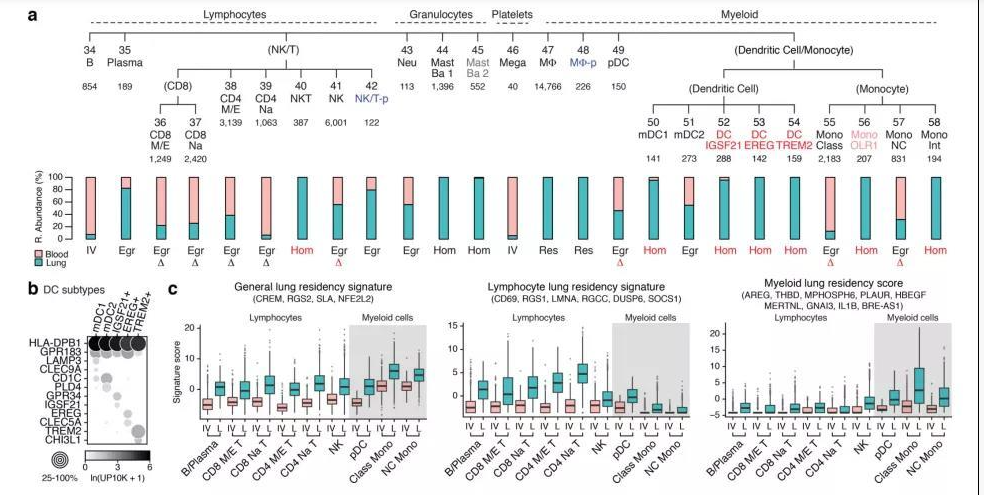
圖3 肺免疫細(xì)胞分群[2]
肺泡上皮細(xì)胞
肺泡上皮細(xì)胞作為氣體交換的單位(圖4),維持著肺臟的基本功能。肺泡上皮細(xì)胞主要由I型肺泡上皮細(xì)胞,Ⅱ型肺泡上皮細(xì)胞組成。
肺泡I型細(xì)胞,其表面標(biāo)志物是水通道蛋白5(AQP5)占肺泡表面積的96%。這些細(xì)胞非常薄,呈鱗狀,它們與肺毛細(xì)血管內(nèi)皮共用一個基底膜,形成氣血屏障,在此發(fā)生氣體交換。
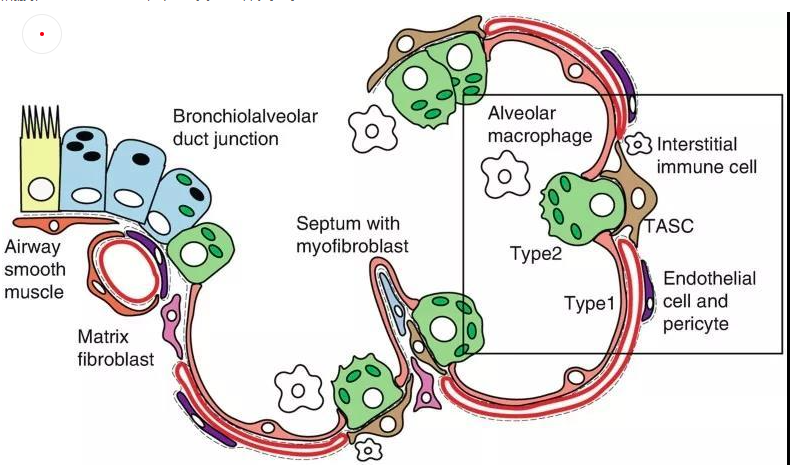
圖4 小鼠肺泡區(qū)示意圖[4]
II型細(xì)胞為球形肺細(xì)胞,其表面標(biāo)志物為SFTPC(又稱為SPC),僅占肺泡表面積的4%,但占肺泡上皮細(xì)胞的60%,占全部肺細(xì)胞的10-15%。Ⅱ型肺泡細(xì)胞位于肺泡拐角處,具有合成、分泌肺表面活性物質(zhì)的功能,還可調(diào)節(jié)肺泡水分,兼有分化成I型細(xì)胞的作用[3]。
肺部內(nèi)皮細(xì)胞
內(nèi)皮細(xì)胞位于滲透在肺部的血管上,它不僅是血液,空氣和基質(zhì)組織之間的物理屏障,還具有代謝活性,參與炎癥控制、白細(xì)胞運(yùn)輸、血管生成和血管張力等過程。根據(jù)最新的單細(xì)胞測序結(jié)果,肺臟內(nèi)皮細(xì)胞可分為淋巴內(nèi)皮細(xì)胞、動脈內(nèi)皮細(xì)胞、普通毛細(xì)血管內(nèi)皮細(xì)胞(General capillary, gCap )、氣管細(xì)胞(Aerocyte)、肺靜脈內(nèi)皮細(xì)胞和全身靜脈內(nèi)皮細(xì)胞[5]。
其中,參與氣體交換的是肺泡毛細(xì)血管內(nèi)皮細(xì)胞,由“氣管細(xì)胞”和普通毛細(xì)血管內(nèi)皮細(xì)胞共同組成。“氣管細(xì)胞”專門用于氣體交換和白細(xì)胞運(yùn)輸,是肺獨(dú)有的內(nèi)皮細(xì)胞;普通毛細(xì)血管內(nèi)皮細(xì)胞用于調(diào)節(jié)血管舒縮張力,并在毛細(xì)血管穩(wěn)態(tài)和修復(fù)中充當(dāng)干細(xì)胞/祖細(xì)胞(圖5)[6]。
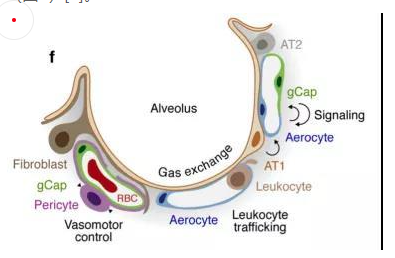
圖5 肺泡氣體交換示意圖[6]
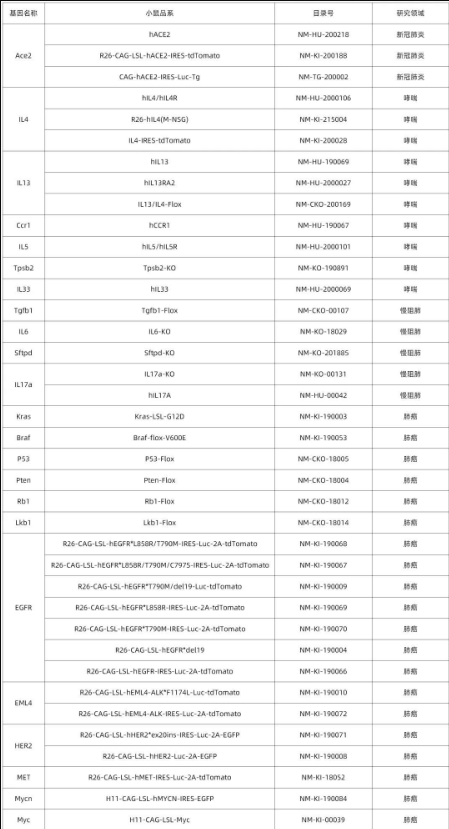
南模生物在小鼠肺部細(xì)胞特定marker基因中敲入Cre/Dre重組酶元件或報告基因,研究者可以對每類細(xì)胞進(jìn)行標(biāo)記,還可以在特定細(xì)胞群里進(jìn)行基因及細(xì)胞功能的研究。具體模型信息見下表:
表1 肺部特定細(xì)胞工具鼠
作為重要的呼吸器官,肺部隨時會侵入細(xì)菌、病毒、真菌、塵埃等,造成不同類型的肺部疾病,如新冠肺炎,大葉性肺炎,支氣管炎等,嚴(yán)重的可導(dǎo)致急性或慢性呼吸衰竭及各類肺癌。目前,人們對這些疾病發(fā)病機(jī)制還不夠了解,因此治療措施十分缺乏。為深入研究疾病的發(fā)生發(fā)展,相關(guān)研究動物模型的構(gòu)建是必不可少的一環(huán)。
新冠肺炎研究模型
自新冠疫情爆發(fā)以來,截至2021年11月8日,全球新冠肺炎累計確診病例已經(jīng)超過2.5億例,全球累計死亡病例超過505萬例。
ACE2 是此次新冠病毒感染人體的主要結(jié)合受體。新冠病毒的刺突糖蛋白可以與肺上皮細(xì)胞細(xì)胞膜上的 ACE2特異性的結(jié)合。通過脂質(zhì)胞膜的內(nèi)吞作用,病毒顆粒與囊泡融合并快速進(jìn)入宿主細(xì)胞內(nèi)[7]。但小鼠細(xì)胞不具有結(jié)合新冠病毒蛋白的能力,因此可以將人ACE2的轉(zhuǎn)入到小鼠體內(nèi),這種小鼠感染SARS-CoV-2后的腸道、肺炎癥狀及病理學(xué)特征與COVID-19患者很相似[8]。南模生物自主研發(fā)了CAG-hACE2-IRES-Luc-Tg(hACE2-Tg) 小鼠,可以作為疫苗和藥物研發(fā)的重要工具。詳細(xì)介紹可見往期推文:傳染病研究殺手锏——常用動物模型介紹
慢性阻塞性肺炎研究模型
慢性阻塞性肺炎(chronic obstructive pulmonary emphysema,COPD)又稱阻塞性肺氣腫,具有終末細(xì)支氣管遠(yuǎn)端部分(包括呼吸性細(xì)支氣管、肺泡管、 肺泡囊和肺泡)膨脹,并伴有氣腔壁的破壞的表現(xiàn)。目前,我國慢阻肺患者人數(shù)約1億,已經(jīng)成為與高血壓、糖尿病“等量齊觀”的慢性疾病,構(gòu)成重大疾病負(fù)擔(dān)[9]。
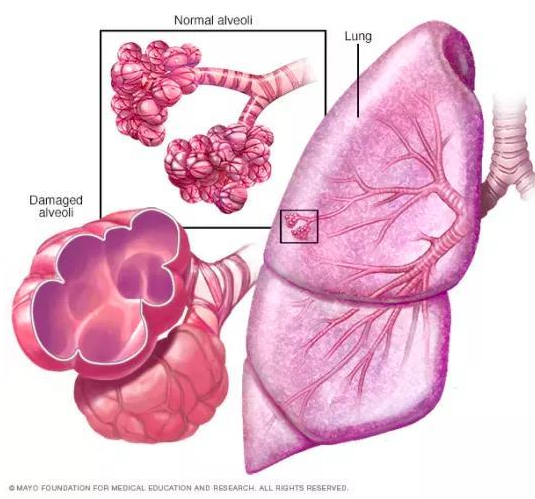
圖6 正常的肺泡和損傷后的肺泡對比圖,損傷后的肺泡失去彈性并過度膨脹(圖片來自網(wǎng)絡(luò))
常規(guī)COPD誘導(dǎo)模型
目前最常用的COPD動物模型是小鼠。通過在香煙煙霧中暴露 6個月,小鼠顯示出人類COPD的一些特征,如慢性肺部炎癥、中度氣道擴(kuò)增和輕度小氣道纖維化[10]。此外,通過彈性蛋白酶進(jìn)行氣管滴注、微生物及其產(chǎn)物誘導(dǎo)或者其他化學(xué)物質(zhì)誘導(dǎo),也有構(gòu)建成功的先例[11]。
基因修飾COPD自發(fā)模型
隨著基因修飾技術(shù)的發(fā)展,通過調(diào)控COPD相關(guān)基因的表達(dá),建立基因工程小鼠模型的應(yīng)用呈上升趨勢。表面活性劑蛋白(Surfactant protein, SP)-D是一種模式識別分子,屬于膠原凝集素蛋白家族。SP-D的主要功能是結(jié)合病原微生物或者寄生蟲,這些生物通過調(diào)理作用被中性粒細(xì)胞清除,從而被吞噬細(xì)胞識別。臨床中發(fā)現(xiàn)具有較高的SP-D水平的患者,其因COPD產(chǎn)生的風(fēng)險較低,肺功能下降速度較緩慢。Sftpd基因(編碼SP-D蛋白)敲除小鼠可出現(xiàn)肺氣腫、進(jìn)行性隔膜壁厚度和胸膜下纖維化,提示這些動物出現(xiàn)肺內(nèi)肺氣腫和纖維化的聯(lián)合表型[12]。
COPD靶點(diǎn)研究模型
IL-17a是COPD中性粒細(xì)胞氣道炎癥的關(guān)鍵介質(zhì)。升高的血清IL-1β和 IL-17a水平可作為COPD持續(xù)性中性粒細(xì)胞氣道炎癥和潛在持續(xù)惡化的生物標(biāo)志物。阻斷IL17a/IL17RA可有效降低香煙煙霧誘導(dǎo)的MUC5AC蛋白、IL6、TNFα和IL-1β等炎癥因子在支氣管上皮細(xì)胞中的表達(dá)。在小鼠體內(nèi)特異性敲除IL17a則有益于減少中性粒細(xì)胞向氣道的募集[13]。這些結(jié)果提示靶向IL17a是潛在的COPD治療手段。
COPD患者除了明顯的肺部特征之外,還存在體重減輕的狀況。臨床上發(fā)現(xiàn),COPD患者的痰液和血清中的白細(xì)胞介素-6 (IL-6)水平較高。因此,科學(xué)家通過構(gòu)建IL6敲除小鼠,與野生型進(jìn)行對比,驗(yàn)證IL6對COPD疾病發(fā)生的影響。研究結(jié)果發(fā)現(xiàn),野生型小鼠和 IL6敲除小鼠同時進(jìn)行香煙煙霧暴露,IL6敲除小鼠具有較低的體重,血清瘦素水平和脂肪組織質(zhì)量,提示IL-6可作為體重的調(diào)節(jié)因子[14]。
南模生物可提供COPD相關(guān)基因及治療靶點(diǎn)敲除小鼠和人源化小鼠,助力COPD相關(guān)研究(見文末表3)。
哮喘研究模型
哮喘又名支氣管哮喘。支氣管哮喘是由多種細(xì)胞及細(xì)胞組分參與的慢性氣道炎癥。目前對哮喘的根本病因尚不能完全了解。罹患哮喘的最大風(fēng)險因素是遺傳易感性與環(huán)境接觸(吸入可能誘發(fā)過敏反應(yīng)或刺激氣道的物質(zhì)和顆粒)二者的結(jié)合,這類物質(zhì)和顆粒包括室內(nèi)過敏源(例如家庭塵螨)、室外過敏源(例如花粉)和煙草煙霧等[15]。

圖7 哮喘產(chǎn)生的癥狀和致敏源
塵螨(HDM)是屋塵過敏的主要過敏源。在已有的研究中證明了塵螨在哮喘的發(fā)展中及誘發(fā)其他過敏性疾病(如皮炎和鼻炎)中起重要作用[16]。HDM的糞便顆粒中含有多種過敏原,這些過敏原是全世界過敏性哮喘的主要誘因,可通過局部使用HDM開發(fā)具有臨床相關(guān)意義的小鼠模型。南模生物可提供塵螨誘導(dǎo)的哮喘模型,詳細(xì)驗(yàn)證數(shù)據(jù)如下。圖1為野生型C57BL/6小鼠經(jīng)塵螨誘導(dǎo)后免疫細(xì)胞數(shù)量變化的結(jié)果,對照組小鼠相比,中心粒細(xì)胞、淋巴細(xì)胞和嗜酸性細(xì)胞的數(shù)量有明顯的增加。
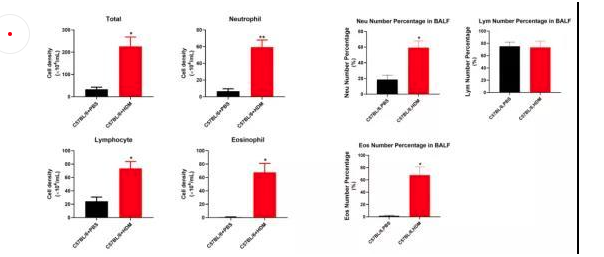
圖8 C57BL/6小鼠在塵螨誘導(dǎo)后各類免疫細(xì)胞數(shù)量的變化
絕大多數(shù)哮喘患者發(fā)作時可通過抗炎、平喘等傳統(tǒng)治療藥物得到控制,但仍有部分患者的病情需要借助全身應(yīng)用高劑量激素才可緩解或仍無法控制,甚至威脅生命。近年來,針對這些難治性重癥哮喘,人們開發(fā)了新的靶向藥物并應(yīng)用于臨床。目前已上市的靶向藥有奧馬珠單抗(抗IgE),IL-5/IL-5R單抗。高潛力在研的重度哮喘藥物有IL-4/IL-13單抗;TSLP抗體;IL-33/ST-2單抗等。南模生物可提供相應(yīng)靶點(diǎn)的人源化小鼠,助力靶向創(chuàng)新藥物的研發(fā)和篩選(見文末表3)。
肺癌研究模型
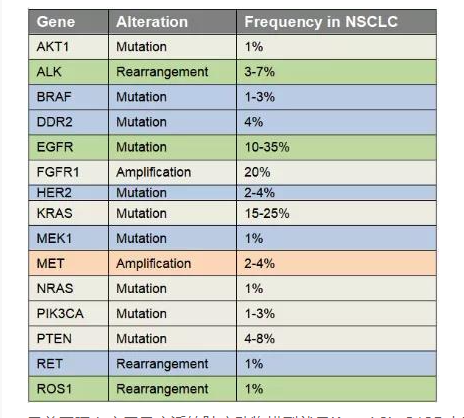
肺癌是起源于上皮組織的惡性腫瘤,在我國各種惡性腫瘤中發(fā)病率和死亡率均排名第一,好發(fā)年齡在70歲以上,男女發(fā)病率之比為2:1。由于空氣污染、放射性暴露以及肺部真菌感染等原因,使得肺癌的發(fā)病率和死亡率久居不下。肺癌主要分為非小細(xì)胞肺癌(non small cell lung cancer, NSCLC)和小細(xì)胞肺癌(small celllung cancer, SCLC),其中非小細(xì)胞肺癌約占肺癌的80~85%[17]。在非小細(xì)胞肺癌中,發(fā)現(xiàn)很多驅(qū)動突變,常見的驅(qū)動突變包括Kras突變、EGFR突變、FGFR1擴(kuò)增、ALK重排、HER2突變、MET擴(kuò)增、BRAF突變等[17]。研究人員對肺癌的多個突變進(jìn)行探究,將肺癌中發(fā)現(xiàn)的突變進(jìn)入引入到小鼠中,從而獲得多種用于研究肺癌發(fā)生與轉(zhuǎn)移機(jī)制、篩選和評價抗腫瘤藥物的肺癌模型。
表2 非小細(xì)胞肺癌中基因突變頻率和類型[17]
目前國際上應(yīng)用最廣泛的肺癌動物模型就是Kras-LSL-G12D小鼠模型,可以通過與肺上皮細(xì)胞特異性的Cre轉(zhuǎn)基因小鼠雜交來實(shí)現(xiàn)Kras突變體的激活,從而導(dǎo)致肺癌的發(fā)生。南模生物提供的Kras(LSL-G12D/+)小鼠品系在Kras突變基因的上游插入了loxp-stop-loxp終止序列,其在沒有cre重組酶的條件下是不表達(dá)的。Cre介導(dǎo)的重組可去除終止密碼子,使致癌基因表達(dá)。采用腺病毒載體攜帶Cre感染肺部細(xì)胞后,導(dǎo)致肺腫瘤發(fā)生的頻率非常高(圖8)。
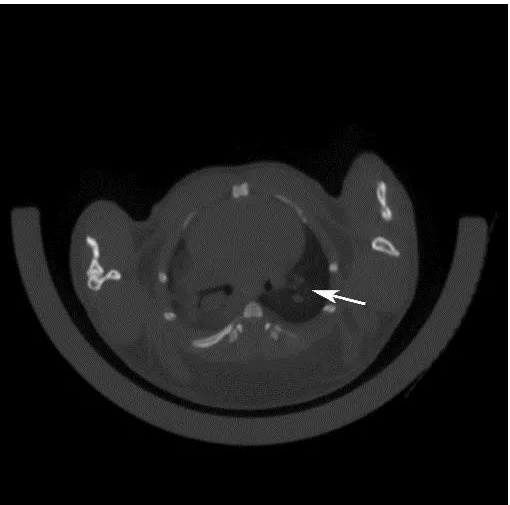
圖9 采用氣管內(nèi)注射的方法,將AAV-cre病毒注射到小鼠肺部,3個月后對小鼠肺部進(jìn)行CT檢測,CT結(jié)果顯示有明顯的腫瘤的形成。
此外,我們還可以提供Kras(LSL-G12D/+)小鼠腫瘤細(xì)胞來源的同系荷瘤小鼠模型。腫瘤細(xì)胞可在受體小鼠體內(nèi)快速增殖(如圖9)。荷瘤小鼠模型可提高臨床藥效評價實(shí)驗(yàn)操作的簡便性。
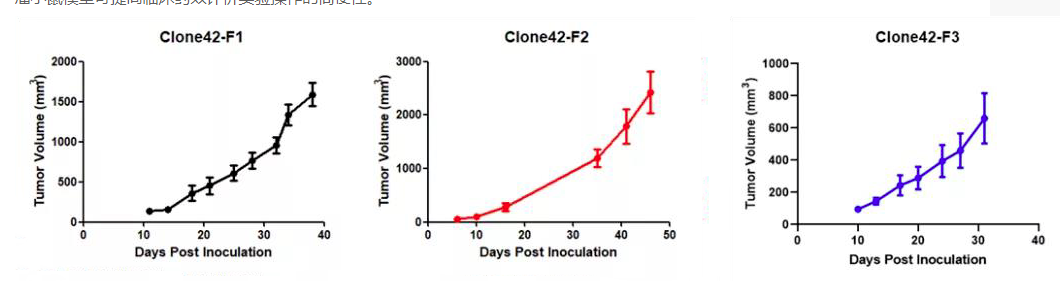
圖10 荷瘤小鼠體內(nèi)腫瘤細(xì)胞體積隨時間增長的變化
關(guān)于肺癌的詳細(xì)介紹可見往期推文:基因工程小鼠疾病模型系列——肺癌篇
南模生物肺病動物模型
南模生物自主構(gòu)建了多種基因修飾小鼠(表3),可以用于新冠肺炎、慢性阻塞性肺炎、哮喘、肺癌等疾病的研究和藥物篩選。
表3 肺部疾病相關(guān)動物模型列表
南模生物深耕基因編輯領(lǐng)域,提供全方位模式生物服務(wù),包括基因修飾成品模型供應(yīng)、個性化模型定制、飼養(yǎng)繁育、表型分析、藥效評價等,滿足不同實(shí)驗(yàn)室需求。
Reference:
[1] https://www.nhlbi.nih.gov/health-topics/how-lungs-work
[2] Travaglini KJ, Nabhan AN, Penland L, et al. A molecular cell atlas of the human lung from single-cell RNA sequencing. Nature. 2020 Nov;587(7835):619-625.
[3] https://www.ncbi.nlm.nih.gov/books/NBK557542/
[4] Hogan B.L.M. (2020) The Alveolar Stem Cell Niche of the Mammalian Lung. In: Nakanishi T., Baldwin H., Fineman J., Yamagishi H. (eds) Molecular Mechanism of Congenital Heart Disease and Pulmonary Hypertension. Springer, Singapore. https://doi.org/10.1007/978-981-15-1185-1_2
[5] Schupp JC, Adams TS, Cosme C Jr, et al. Integrated Single-Cell Atlas of Endothelial Cells of the Human Lung. Circulation. 2021 Jul 27;144(4):286-302. doi: 10.1161/CIRCULATIONAHA.120.052318.
[6]Gillich A, Zhang F, Farmer CG, Travaglini KJ, Tan SY, Gu M, Zhou B, Feinstein JA, Krasnow MA, Metzger RJ. Capillary cell-type specialization in the alveolus. Nature. 2020 Oct;586(7831):785-789. doi: 10.1038/s41586-020-2822-7.
[7] Bohn MK, Hall A, Sepiashvili L, Jung B, Steele S, Adeli K. Pathophysiology of COVID-19: Mechanisms Underlying Disease Severity and Progression. Physiology (Bethesda). 2020 Sep 1;35(5):288-301.
[8] Jiang RD, Liu MQ, Chen Y, et al. Pathogenesis of SARS-CoV-2 in Transgenic Mice Expressing Human Angiotensin-Converting Enzyme 2. Cell. 2020 Jul 9;182(1):50-58.e8.
[9]Wang C, Xu J, Yang L, Xu Y, et al; China Pulmonary Health Study Group. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health [CPH] study): a national cross-sectional study. Lancet. 2018 Apr 28;391(10131):1706-1717.
[10]Churg A, Cosio M, Wright JL. Mechanisms of cigarette smoke-induced COPD: insights from animal models[ J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(4): L612-L631.
[11]李麗球, 謝麗華, 孫圣華. 慢性阻塞性肺疾病動物模型的研究進(jìn)展[J]. 中南大學(xué)學(xué)報:醫(yī)學(xué)版, 2017, 42(9):6.
[12] Barreiro E, Wang X, Tang J. COPD: preclinical models and emerging therapeutic targets. Expert Opin Ther Targets. 2019 Oct;23(10):829-838. doi: 10.1080/14728222.2019.1667976. Epub 2019 Sep 20. PMID: 31512957.
[13] Wu M, Lai T, Jing D,et al. Epithelium-derived IL17A Promotes Cigarette Smoke-induced Inflammation and Mucus Hyperproduction. Am J Respir Cell Mol Biol. 2021 Jun 29.
[14] Pauwels NS, Bracke KR, Maes T, et al. The role of interleukin-6 in pulmonary and systemic manifestations in a murine model of chronic obstructive pulmonary disease. Exp Lung Res. 2010 Oct;36(8):469-83.
[15]https://www.who.int/zh/news-room/fact-sheets/detail/asthma
[16]Tang W, Dong M, Teng F, Cui J, Zhu X, Wang W, Wuniqiemu T, Qin J, Yi L, Wang S, Dong J, Wei Y. Environmental allergens house dust mite-induced asthma is associated with ferroptosis in the lungs. Exp Ther Med. 2021 Dec;22(6):1483.
[17]Min-chul Kwon, Anton Berns. Mouse models for lung cancer. MOLECULAR ONCOLOGY 7 (2013) 165e177.




 17312606166
17312606166 加微信獲取對接
加微信獲取對接