
目前,免疫學是當今生命科學學科和支撐學科的現代醫學的前沿陣地之一。免疫學在生物結構與機能的各個層面都有科學基本問題的發現,在臨床應用領域,生物高科技產業,藥物研制開發中有很大價值。目前免疫學研究主要集中在基礎免疫學和臨床免疫學兩方面。
在基礎免疫學方面,研究方向集中在免疫系統發育、免疫細胞識別、信號轉導、活化和效應機制、免疫分子的發現與應用等等。這些方向的研究前提在于準確地了解免疫系統,明確免疫細胞種類。下面,鼠博士簡要為大家介紹一下各種免疫細胞的細胞標志物。
![圖1:HSC的分化[1].jpg 圖1:HSC的分化[1].jpg](https://videos.modelorg.com/default/20231116/a4b8c987b1367e92502b8276b42d28d0.jpg!original)
圖1:HSC的分化[1]
非特異性免疫細胞:
組成:單核細胞、巨噬細胞、NK細胞、DC細胞、粒細胞等
單核細胞——通用標志物:CD14

單核細胞(monocytes)是血液中最大的免疫細胞。它們在體內巡邏,為抵御細菌和真菌入侵提供第一道防線,可以通過細胞因子分泌引發炎癥,并觸發適應性免疫,迅速遷移到外周組織,分化為樹突狀細胞或巨噬細胞。
![圖2. 單核細胞的分化[2].png 圖2. 單核細胞的分化[2].png](https://videos.modelorg.com/default/20231116/7fcc87fc57b165acaf4da1dfb3c53129.png!original)
圖2. 單核細胞的分化[2]
單核細胞的通用標志物是CD14。而根據CD14、CD16 (Fcγ RIII)、CD64 (Fcγ RI)和趨化因子受體CD192和CX3CR1的表達水平可將人外周血單核細胞群定義為三個不同的亞群:經典型、中間型和非經典型,三種亞型的標志物見下表

*紅色表示高表達,藍色表示低表達。
巨噬細胞——通用標志物:CD68

巨噬細胞(Macrophages)是一種分布廣泛且功能多樣的白細胞,具有清除入侵者和啟動免疫應答的吞噬能力。然而,巨噬細胞也具有維持其他微環境的穩態功能,如維持代謝平衡。巨噬細胞高度參與腫瘤的發生和發展,因為腫瘤相關巨噬細胞(TAM)可分泌對腫瘤細胞免疫耐受的誘導因子。因此,它們在免疫腫瘤學中非常重要,是研究評估治療對腫瘤微環境(TME)影響的核心內容。
![圖3. 巨噬細胞在組織和疾病環境中的命運[3].jpg 圖3. 巨噬細胞在組織和疾病環境中的命運[3].jpg](https://videos.modelorg.com/default/20231116/5ac292fbed84a65c49408fcbc39913b9.jpg!original)
圖3. 巨噬細胞在組織和疾病環境中的命運[3]
巨噬細胞的通用標志物是CD68。而根據巨噬細胞在炎癥反應中的功能和活化程度可分為兩個亞型:具有促炎癥作用的M1巨噬細胞和具有免疫抑制作用的M2巨噬細胞。M1亞型的標志物有CD80/CD86/IL-1/IL-12,M2亞型的標志物有CD206/CD301/CD163/IL-10/Arg-1等。
![圖4. 巨噬細胞極化[4].jpg 圖4. 巨噬細胞極化[4].jpg](https://videos.modelorg.com/default/20231116/a8f9bad0903fdb220f5a3d11d56d6ef7.jpg!original)
圖4. 巨噬細胞極化[4]
DC細胞——通用標志物:CD11c、BDCA-1/2以及CD123

樹突狀細胞(dendritic cell, DC)是一種專業的抗原提呈細胞,它通過對T、B淋巴細胞的抗原加工和提呈,將先天免疫和適應性免疫聯系起來。
樹突狀細胞主要分為三類:
01
漿細胞樣樹突狀細胞(pDC),專精于識別病毒和腫瘤細胞;
02
I型經典樹突狀細胞(cDC1),能夠識別細胞內病原體并觸發CD8 T 細胞和Th1 CD4 T細胞應答;
03
II型經典樹突狀細胞(cDC2),在與細胞內病原體、寄生蟲、變應原、真菌和細胞外細菌接觸時,會觸發CD4 T細胞反應。
![圖5. 小鼠DC細胞發育譜系圖[5].png 圖5. 小鼠DC細胞發育譜系圖[5].png](https://videos.modelorg.com/default/20231116/828ee7c959f183ff3a7f8160736b6ee4.png!original)
圖5. 小鼠DC細胞發育譜系圖[5]
樹突狀細胞的常規標記物包括CD11c、BDCA-1/2以及CD123。
粒細胞——暫無通用標志物

粒細胞(granulocytes)是富含細胞質顆粒的細胞,包括嗜堿性粒細胞、嗜中性粒細胞、嗜酸性粒細胞以及肥大細胞。粒細胞支持一系列保護功能,包括吞噬功能(嗜中性粒細胞)、防御寄生蟲(嗜堿性粒細胞)以及作為變態反應的效應物(肥大細胞),并且還能在免疫治療期間調節宿主的反應。
粒細胞亞群的標志物和功能如下表:

NK細胞——通用標志物:CD16、CD56以及小鼠NK1.1
自然殺傷細胞是一類先天免疫細胞,但在形態上及淋巴標記物表達上,與淋巴細胞相似。其特點為不依賴抗體和補體即可直接殺傷細胞,且無MHC限制。因此,NK細胞不會生成免疫記憶或產生長期保護性免疫。
![圖6. NK細胞亞群分布[6].jpg 圖6. NK細胞亞群分布[6].jpg](https://videos.modelorg.com/default/20231116/48af8fa786c5263ff18b7ab14ef683a3.jpg!original)
圖6. NK細胞亞群分布[6]
NK細胞的特征性標記物包括人CD16、CD56以及小鼠NK1.1。
特異性免疫細胞:
組成:T細胞、B細胞等
T細胞——通用標志物:CD3和T細胞受體(TCR)

T細胞(T lymphocyte)起源于骨髓,然后轉移到胸腺中發育成熟。在過去的十幾年中,T細胞一直是研究熱點,例如研究T細胞受體的免疫檢查點抑制劑(PD-1、CTLA-4等)。目前已經有方法可以解除腫瘤微環境對T細胞增殖和激活的抑制,這一成果已經成功應用于黑色素瘤以及其他腫瘤的治療。
![圖7. T細胞的分化過程[7].jpg 圖7. T細胞的分化過程[7].jpg](https://videos.modelorg.com/default/20231116/b7a0544c0fe60569b2dc4750067e35a1.jpg!original)
圖7. T細胞的分化過程[7]
T細胞的特征標記物包括CD3和T細胞受體(TCR)。根據表達類型,它們可以分為CD4+ T細胞和CD8+ T細胞,其中CD4+ T細胞主要為輔助T細胞(helper T cell);CD8+ T細胞主要為細胞毒T細胞(cytotoxic T cell);此外還有抑制免疫應答的調節性T細胞(T-reg),以及記憶T細胞、NKT細胞等。CD4+ T細胞和CD8+ T細胞根據其他表面標志物又可以進一步分為更多亞群(如下圖)。
![圖8. CD4+ T細胞和CDB+T細胞的亞型[7].jpg 圖8. CD4+ T細胞和CDB+T細胞的亞型[7].jpg](https://videos.modelorg.com/default/20231116/b143deaa4ae9dfcedc92e83793ff61d9.jpg!original)
圖8. CD4+ T細胞和CDB+T細胞的亞型[7]

B細胞——通用標志物:CD21

B細胞(B lymphocyte)在骨髓中開始發育成熟。眾所周知,B細胞能夠通過產生抗體來支持體液免疫,但是它們還具有其他的關鍵功能,比如吞噬功能和交叉呈遞功能。
![圖9. B細胞發育和B細胞亞群[9].jpg 圖9. B細胞發育和B細胞亞群[9].jpg](https://videos.modelorg.com/default/20231116/9b0d2a5606812c1ac250f59d68ec08e7.jpg!original)
圖9. B細胞發育和B細胞亞群[9]
與其他淋巴細胞一樣,B細胞的標記物也在成熟和分化過程中發生進化,其通用標志為CD21,其他分型如下:
(1)不成熟B細胞(immature B cell)標志物:CD21/CD19/CD20/MHCⅡ/mIgM
(2)成熟B細胞(mature B cell)標志物:CD21/mIgM/mIgD/CR1
(3)活化B細胞(activated B cell)標志物:CD21/sIgM/sIgD
(4)漿細胞(plasma cell PC)標志物:PC-1
南模生物根據免疫細胞發育分化的標志性marker,自主構建了多種Cre工具鼠、搭配特定基因條件性敲除小鼠、熒光工具鼠等動物模型,可用于研究該基因在免疫細胞亞群中的功能、或研究免疫細胞的發育分譜系。此外還有多種DTR工具鼠,可以在小鼠體內剔除特定類型的免疫細胞,如Lyz2-DTR,可以剔除小鼠體內的巨噬細胞,Tmem119-DTR,可以剔除小鼠體內的小膠質細胞等。
詳細模型信息見下表:
T、B、NK細胞Cre工具鼠

造血干細胞、巨噬細胞、單核細胞等Cre工具鼠

粒細胞、DC細胞等Cre工具鼠

各類免疫細胞剔除(DTR)工具鼠


現代免疫學已成為生命科學和醫學中的前沿科學,在臨床免疫學方面,目前的研究主要包括:多種傳染疾病的疫苗研制;自身免疫性疾病、過敏性疾病、防止移植排斥的治療方法;抗體cDNA表達文庫的開發應用;免疫藥物的開發。而想要在這些臨床研究中所向披靡,離不開鼠鼠免疫大軍的三大神兵!
免疫治療靶點人源化小鼠模型,指通過基因修飾的手段將免疫治療靶點替換為相應的人源基因,使小鼠表達人源的藥物靶點(包括免疫檢查點在內)。

靶點人源化小鼠的應用領域相當廣泛,可用于研究人類基因的功能、相關疾病,推動個性化醫療研究,也可用于深入探究生物醫學領域,支持臨床治療方法的研發等。
南模生物特別推出的藥物靶標人源化動物模型資源庫U-HuDTMbase?,包含了自主研發的500多種人源化小鼠品系(包括雙靶標、三靶標、四靶標人源化小鼠),模型資源庫涵蓋目前最新最熱的免疫治療靶點,部分熱門成品人源化小鼠目錄如下:


免疫缺陷小鼠(immunodeficiency mice)是指由于先天性遺傳突變、或用人工方法造成一種或多種免疫系統組成成分缺陷的小鼠。免疫缺陷小鼠在免疫、腫瘤、移植以及轉化醫學研究中使用非常廣泛,許多免疫相關的研究中都需要免疫缺陷小鼠的幫助。
南模生物具有豐富的免疫缺陷小鼠資源庫,包含多種不同免疫缺陷程度的小鼠品系(見下圖),以滿足您的科研需要。

此外,南模生物還自主研發了重度免疫缺陷小鼠——M-NSG小鼠。M-NSG缺乏成熟的 T、B 和 NK 細胞,對人源細胞和組織免疫排斥反應低,腫瘤細胞成瘤性好,是人源化小鼠、異種移植、免疫重建的重要載體;對于研究人類造血干細胞、腫瘤發生與治療、免疫缺陷疾病與體內免疫機制研究都具有重要意義。
我們基于M-NSG小鼠構建了諸多衍生品系,以滿足您的不同實驗要求(見下表):

免疫系統人源化小鼠模型是通過將人的造血細胞、淋巴細胞或組織植入免疫缺陷小鼠體內,從而使其重建人類免疫系統的小鼠模型。它們可有效地重建人類免疫系統,更好地模擬人體免疫特征。

由于小鼠和人類免疫反應之間存在許多物種特異性差異,導致在動物模型中成功的療法在臨床轉化中遇到許多困難。免疫系統人源化小鼠的成功構建對于很多人類疾病和生理研究都有著重要意義,如同種異體移植排斥、自身免疫疾病、人類傳染性疾病、腫瘤免疫研究等。
南模生物自主研發的Hu-PBMC和Hu-HSC模型,分別移植了人外周血單核細胞和CD34+ 造血干細胞以構建免疫系統人源化小鼠,可以更有效地模擬人體免疫應答,為腫瘤免疫、自身免疫性疾病、特異性傳染疾病的臨床前研究提供了優秀模型。

[1] Dzierzak E, Philipsen S. Erythropoiesis: development and differentiation. Cold Spring Harb Perspect Med. 2013;3(4):a011601. Published 2013 Apr 1. doi:10.1101/cshperspect.a011601
[2] Collin M, Bigley V. Monocyte, Macrophage, and Dendritic Cell Development: the Human Perspective. Microbiol Spectr. 2016;4(5):10.1128/microbiolspec.MCHD-0015-2015. doi:10.1128/microbiolspec.MCHD-0015-2015
[3] Varol C, Mildner A, Jung S. Macrophages: development and tissue specialization. Annu Rev Immunol. 2015;33:643-675. doi:10.1146/annurev-immunol-032414-112220
[4] Wang Y, Smith W, Hao D, He B, Kong L. M1 and M2 macrophage polarization and potentially therapeutic naturally occurring compounds. Int Immunopharmacol. 2019;70:459-466. doi:10.1016/j.intimp.2019.02.050
[5] Anderson DA 3rd, Dutertre CA, Ginhoux F, Murphy KM. Genetic models of human and mouse dendritic cell development and function. Nat Rev Immunol. 2021;21(2):101-115. doi:10.1038/s41577-020-00413-x
[6] Dogra P, Rancan C, Ma W, et al. Tissue Determinants of Human NK Cell Development, Function, and Residence. Cell. 2020;180(4):749-763.e13. doi:10.1016/j.cell.2020.01.022
[7] Mousset CM, Hobo W, Woestenenk R, Preijers F, Dolstra H, van der Waart AB. Comprehensive Phenotyping of T Cells Using Flow Cytometry. Cytometry A. 2019;95(6):647-654. doi:10.1002/cyto.a.23724
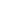




 17312606166
17312606166