上海交通大學醫學院松江研究院/中國科學院腦科學與智能技術卓越創新中心(神經科學研究所)仇子龍團隊與復旦大學腦科學轉化研究院程田林團隊合作,在神經科學國際權威期刊NatureNeuroscience上發表了題為:Whole-braininvivobaseeditingreversesbehavioralchangesinMef2cmutantmice的研究論文。
該研究首次報道了在全腦范圍內利用單堿基編輯技術,成功改善MEF2C孤獨癥小鼠模型神經發育與孤獨癥樣核心行為表型。

仇子龍研究團隊通過全外顯子組測序技術在一例中國的孤獨癥患兒的MEF2C基因上發現了一個新發點突變(denovomutation),c.T104C,p.L35P,MEF2C基因已被證實是一個很重要的孤獨癥風險基因,突變會導致神經發育遲滯及一系列嚴重癥狀,但是該新發點突變對于MEF2C基因功能的影響未知。
研究團隊首先利用分子細胞生物學的研究方法在體外探究了L35P點突變對MEF2C蛋白結構、表達以及功能上的影響及其分子機制(圖I和圖II)。研究團隊發現L35P突變會導致MEF2C蛋白質發生依賴泛素化蛋白酶體途徑的快速降解(圖II),最終顯著降低MEF2C蛋白的表達水平(圖I)。
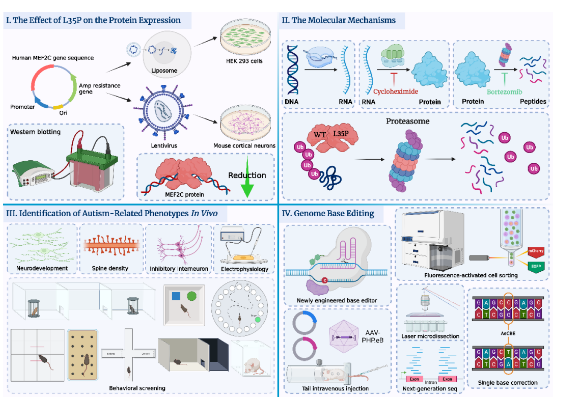
圖I:L35P點突變會顯著降低MEF2C蛋白表達水平。
圖II:L35P點突變會通過泛素化蛋白酶體降解途徑介導MEF2C蛋白翻譯后快速降解,且表現出dominantnegativeeffect。
圖III:Mef2cL35P雜合小鼠表現出與孤獨癥相關的異常神經發育,突觸密度降低,抑制性中間神經元數量下降及異常的電生理表型,且會出現孤獨癥相關的行為學表型。
圖IV:基于CRISPR/Cas9系統開發的新型胞嘧啶單堿基編輯系統,通過體內及體外驗證了其在目標靶點的堿基編輯效率以及脫靶事件,證明該系統是高效,準確且安全的。
為了研究L35P基因突變對小鼠行為學表型的影響,研究團隊構建了Mef2cL35P點突變敲入小鼠模型,并通過生物化學、免疫熒光成像以及行為學實驗探究了其神經發育及行為學表型。研究發現Mef2cL35P雜合突變小鼠大腦中存在孤獨癥相關的神經生理學特征以及發育異常現象,并且表現出社交障礙以及刻板行為等孤獨癥核心癥狀的行為學表型(圖III)。
隨后,為了修復小鼠大腦神經元中的L35P點突變,仇子龍和程田林團隊合作開發了一種基于CRISPR-Cas9的新型胞嘧啶單堿基編輯系統(APOBEC3AembeddingCytosineBaseEditor,AeCBE),使其能夠將小鼠Mef2c基因中特定位置上異常的C·G堿基對轉換成正常的T·A堿基對。
為了能夠使得AeCBE系統成功地跨越小鼠血腦屏障(BBB),研究團隊將AeCBE系統包裝進PHP.eB血清型腺相關病毒(AAV)中,并且利用單次小鼠尾靜脈注射AAV的遞送方式,使得AeCBE系統在小鼠大腦中得以成功表達。經AeCBE系統編輯后,研究團隊在體內檢測到較高的單堿基編輯效率以及低脫靶事件,驗證了新開發的AeCBE系統具備高效性、準確性且安全性的特點(圖IV)。
最后,研究團隊檢測了經過AeCBE堿基編輯系統介導的基因治療后Mef2cL35P突變雜合小鼠大腦中的神經生理學變化以及行為學表型。在經過單堿基編輯技術介導的基因修復后,研究團隊發現Mef2cL35P突變雜合小鼠大腦中降低的Mef2c蛋白表達水平得到恢復,并且其社交障礙以及重復刻板性行為也得到了明顯的改善。
總的來說,該研究提出了一種利用CRISPR-Cas9介導的單堿基編輯系統在全腦水平修復致病基因單核苷酸突變的體內基因編輯策略,從而為各種大腦遺傳疾病提供新的治療方案和思路。
上海交通大學醫學院松江研究院/中國科學院腦智卓越中心仇子龍研究員和復旦大學腦科學轉化研究院程田林研究員為該論文共同通訊作者。中國科學院腦智卓越中心李維克博士、復旦大學腦科學轉化研究院博士生張淑倩為該論文共同第一作者。




 17312606166
17312606166