全球高達(dá)4億多人飽受糖尿病困擾,其中我國(guó)糖尿病患病人數(shù)居全球之首,已超1.3 億,占全國(guó)總?cè)丝诘?9.4%[1]。胰高血糖素樣肽-1受體(glucagon-like peptide-1 receptor, GLP-1R)是治療2型糖尿病最有效的靶點(diǎn)之一。
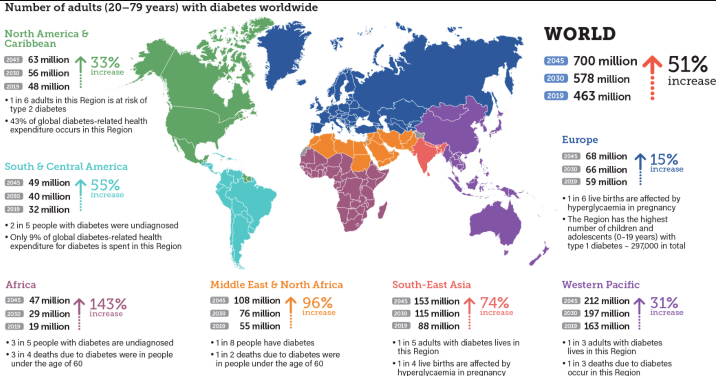
圖1 全球糖尿病患者統(tǒng)計(jì)
昨日(8月18日)信達(dá)生物的新型GLP-1R/GCGR雙激動(dòng)劑IBI362 (LY3305677)一期臨床結(jié)果在國(guó)際知名期刊柳葉刀子刊EClinicalMedicine上發(fā)表。今年4月,諾和諾德的GLP-1R激動(dòng)劑多肽司美格魯肽注射液在國(guó)內(nèi)上市,每周只需皮下注射1次。目前國(guó)內(nèi)上市的GLP-1R激動(dòng)劑類藥物達(dá)到8款,它們不僅降糖效果顯著,同時(shí)還兼具減重、降壓、改善血脂譜等作用。近年來(lái)GLP-1R激動(dòng)劑類藥物市場(chǎng)規(guī)模不斷增長(zhǎng),2020年全球市場(chǎng)規(guī)模已達(dá)100億美元。
GLP-1R為何能在2型糖尿病治療上大放異彩,今天小編帶大家一探究竟。
GLP-1R簡(jiǎn)介
GLP-1R屬于G蛋白偶聯(lián)受體B簇中胰高血糖素受體亞家族,它的典型特征是具有一個(gè)七次跨膜的核心域和一個(gè)相對(duì)比較大的胞外域[2]。人的GLP-1R基因位于第6號(hào)染色體上,編碼463個(gè)氨基酸。胰腺內(nèi)的GLP-1R主要表達(dá)在胰島β細(xì)胞中,除胰島外,GLP-1R還廣泛表達(dá)于胃、小腸、心臟、腎臟、肺及大腦等組織器官中[3]。顧名思義,GLP-1R的主要作用是和胰高血糖素樣肽-1(glucagon-like peptide-1 receptor, GLP-1)結(jié)合,調(diào)節(jié)血糖。
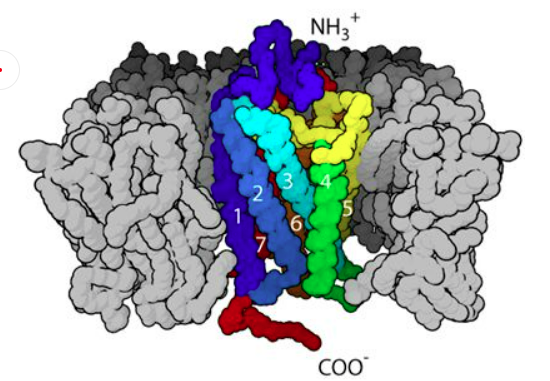
圖2 GLP-1R跨膜區(qū)三維結(jié)構(gòu)
GLP-1
GLP-1是一種主要由腸道L細(xì)胞所產(chǎn)生的激素,屬于腸促胰素。GLP-1的半衰期非常短,僅1-2min,其發(fā)揮生理功能主要是通過(guò)結(jié)合并激活GLP-1R。人體內(nèi)腸促胰素除GLP-1外還有葡萄糖依賴性胰島素釋放肽(GIP),但是只有GLP-1可以抑制胰高血糖素的釋放,引起飽足感[4]。截止到2021年,臨床上腸促胰素類藥物均基于GLP-1。
GLP-1R的功能
GLP-1R廣泛分布在胰島、胃、小腸、心臟、腎臟、肺、大腦等組織器官中,當(dāng)它被GLP-1或人工合成的GLP-1R激動(dòng)劑激活后,便能發(fā)揮多種不同的生理功能。在胰島細(xì)胞中,GLP-1R的主要作用是促進(jìn)胰島β細(xì)胞的增殖,刺激胰島素的合成與釋放,并抑制胰高血糖素的合成與釋放。在胃腸道等組織中,GLP-1R可以抑制胃液分泌和胃腸道的蠕動(dòng),延遲胃的排空,增加飽食感,減少食物攝取[4]。在神經(jīng)組織中,GLP-1R可以保護(hù)神經(jīng)細(xì)胞,抵抗食欲不振,增強(qiáng)記憶力。在心血管方面,GLP-1R可以提升心血管的功能,減少炎癥[5]。
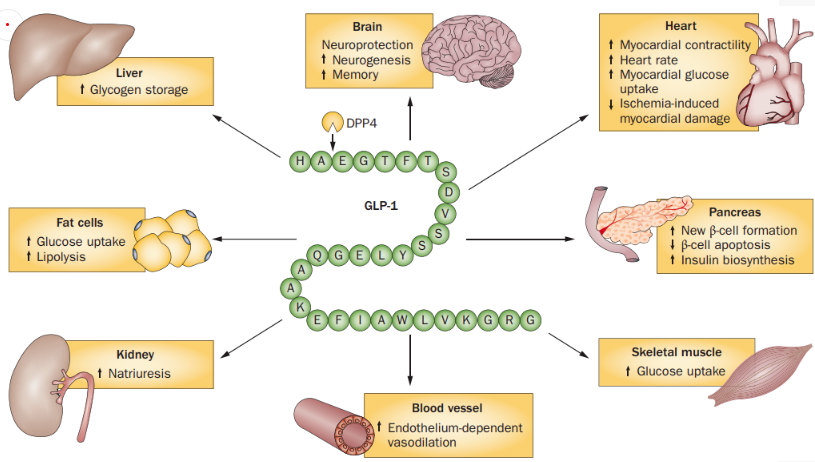
圖3 GLP-1R的生理功能
GLP-1R的激活
GLP-1R與配體的結(jié)合方式主要是大家熟知的“two-domain model”。配體的C端先同GLP-1R的胞外域結(jié)合,使GLP-1R的空間構(gòu)象發(fā)生改變,暴露出核心域的結(jié)合位點(diǎn),然后配體的N端同GLP-1R的核心域結(jié)合,激活GLP-1R。一般來(lái)說(shuō),GLP-1R胞外域的主要作用是識(shí)別特異性的配體,而核心域則在信號(hào)特異性傳導(dǎo)中發(fā)揮重要作用[6]。
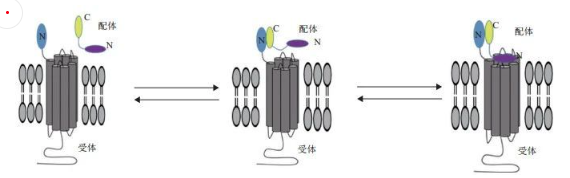
圖4 GLP-1R與配體結(jié)合的模式圖
GLP-1R信號(hào)轉(zhuǎn)導(dǎo)調(diào)控機(jī)制
GLP-1R是一種多效性偶聯(lián)受體,主要通過(guò)與多種G蛋白(Gαs、Gαi、Gαo和Gαq/11)偶聯(lián)來(lái)調(diào)控細(xì)胞通路。當(dāng)與GLP-1結(jié)合后,GLP-1R在胰島β細(xì)胞中偶聯(lián)Gαs蛋白,激活腺苷環(huán)化酶,促使cAMP在細(xì)胞內(nèi)含量升高,引起鈣離子內(nèi)流,胰島素原基因轉(zhuǎn)錄增加,刺激血糖依賴性胰島素的分泌[7]。除此之外,GLP-1R還可以通過(guò)激活PI3K、MAPK和Ras/MAPK信號(hào)通路來(lái)促進(jìn)胰島β細(xì)胞的增殖和分化。不僅如此,GLP-1R還能夠通過(guò)調(diào)控cAMP反應(yīng)元件結(jié)合蛋白(CREB)和蛋白復(fù)活因子Bcl-2、Bcl-XL等來(lái)抑制細(xì)胞凋亡[8]。
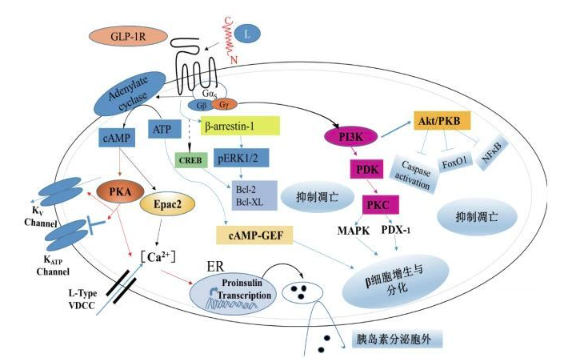
圖5 胰島β細(xì)胞中GLP-1R調(diào)控的信號(hào)通路
小分子非肽類GLP-1R激動(dòng)劑
2019年諾和諾德宣布FDA批準(zhǔn)其口服索馬魯肽(商品名Rybelsus)上市,成為全球首款口服GLP-1R激動(dòng)劑。口服索馬魯肽的出現(xiàn)打破了糖尿病患者需要每天或每周注射藥物的現(xiàn)狀,備受市場(chǎng)關(guān)注,掀起了小分子非肽類GLP-1R激動(dòng)劑藥物的研發(fā)狂潮!
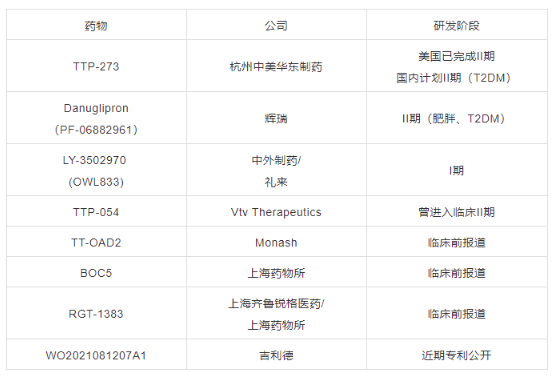
表1 在研小分子GLP-1R激動(dòng)劑
GLP-1R人源化小鼠
鑒于GLP-1R在2型糖尿病藥物開(kāi)發(fā)中的重要作用,上海南方模式生物科技股份有限公司(Shanghai Model Organisms Center,Inc.,簡(jiǎn)稱“南模生物”)自主研發(fā)了GLP-1R人源化小鼠模型,為糖尿病藥物篩選,相關(guān)藥效實(shí)驗(yàn)等研究提供了強(qiáng)有力的工具。
降血糖藥效驗(yàn)證
GLP-1R人源化小鼠,在給藥和不給藥的條件下進(jìn)行口服糖耐量(OGTT)實(shí)驗(yàn)(n=5)。
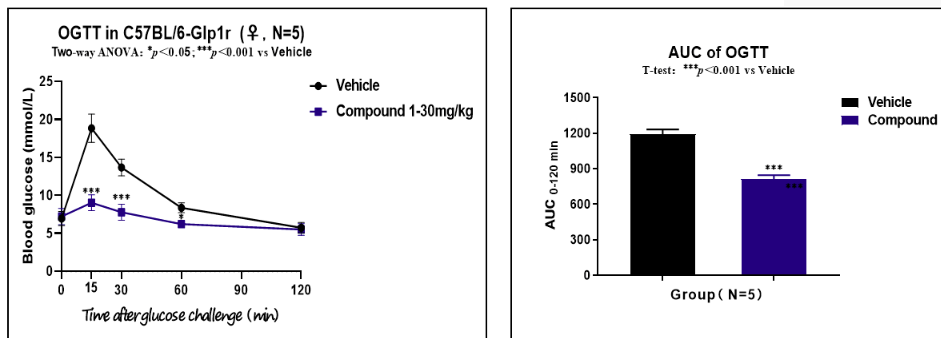
圖6 OGTT實(shí)驗(yàn)(驗(yàn)證數(shù)據(jù)由客戶提供)
結(jié)果顯示:針對(duì)人源GLP-1R,待測(cè)化合物表現(xiàn)出很好的降血糖效果(p<0.001)。上述數(shù)據(jù)證明,GLP-1R人源化小鼠模型,是進(jìn)行糖尿病藥物篩選的有效工具。
南模生物深耕基因編輯領(lǐng)域,提供全方位模式生物服務(wù),包括基因修飾成品模型供應(yīng)、個(gè)性化模型定制、飼養(yǎng)繁育、表型分析、藥效評(píng)價(jià)等,滿足不同實(shí)驗(yàn)室需求。
Reference:
[1]國(guó)際糖尿病聯(lián)盟 IDF 2019全球糖尿病地圖(第9版)
[2]Blad CC, Tang C, Offermanns S. G protein-coupled receptors for energy metabolites as new therapeutic targets. Nature Reviews Drug Discovery, 2012, 11 : 603–619.
[3]Pabreja K, Mohd MA, Koole C, et al. Molecular mechanisms underlying physiological and receptor pleiotropic effects mediated by GLP-1R activation. British Journal of Pharmacology, 2014, 171 : 1114–1128. DOI:10.1111/bph.12313
[4]Brubaker PL, Drucker DJ. Structure-function of the glucagon receptor family of G protein-coupled receptors: the glucagon, GIP, GLP-1, and GLP-2 receptors. Receptors & Channels, 2011, 8 : 179–188.
[5]Laviola L, Leonardini A, Melchiorre M, et al. Glucagon-like peptide-1 counteracts oxidative stress-dependent apoptosis of human cardiac progenitor cells by inhibiting the activation of the c-Jun N-terminal protein kinase signaling pathway. Endocrinology, 2012, 153 : 5770–5781. DOI:10.1210/en.2012-1461
[6]胡中平, 程念, 楊帆, 蘇正定. GLP-1R結(jié)構(gòu)和功能及小分子藥物篩選研究進(jìn)展[J]. 生物技術(shù)通報(bào), 2017, 33(2): 30-40
[7]Dalle S, Ravier MA, Bertrand G. Emerging roles for β-arrestin-1 in the control of the pancreatic β-cell function and mass: New therapeutic strategies and consequences for drug screening. Cellular Signalling, 2011, 23 : 522–528. DOI:10.1016/j.cellsig.2010.09.014
[8]Robert G, Xiaomang Y, Baggio LL, et al. Cardiac function in mice lacking the glucagon-like peptide-1 receptor. Endocrinology, 2003, 144 : 2242–2252. DOI:10.1210/en.2003-0007




 17312606166
17312606166 加微信獲取對(duì)接
加微信獲取對(duì)接