摘要:近年來,斑馬魚已成為心血管研究的強有力的脊椎動物模型。它的優點包括易于遺傳操作、透明、體積小、成本低,以及在發育早期無活躍循環的情況下生存的能力。對整個基因組進行測序,并用人類基因組識別正位基因,使得通過遺傳途徑誘導臨床相關的心血管缺陷成為可能。對于這些疾病模型,需要以可靠的方式評估心臟功能和受干擾的血流動力學,以揭示誘導缺陷的機械力學生物學。這項工作需要精確測定發育中心臟內的血流模式和血流動力學應力(即壁剪切應力和壓力)水平。傳統的方法是利用延時的明視野顯微鏡來跟蹤細胞和組織的運動,但在最近的研究中,快速的光片熒光顯微鏡被用于這一目的。將更復雜的技術如粒子圖像測速和計算流體動力學模型相結合用于血流動力學分析,有助于斑馬魚的研究。我們討論了斑馬魚胚胎心臟功能和血流動力學分析的最新進展,并總結了我們對斑馬魚心血管系統動力學分析的未來展望。
簡介:小鼠是已建立的哺乳動物心血管研究模型。敲除小鼠模型使研究許多先天性心臟缺陷(CHD)類型成為可能。胚胎雞是一種常用的脊椎動物模型,具有類似于人的心臟結構的優點,具有四腔/四瓣結構,能夠進行臨床相關的手術操作。胚胎斑馬魚最近出現在心血管研究中,用于高通量研究。盡管斑馬魚心臟與人類心臟不同,只是系統循環,但兩者的心臟結構和生理學是相似的。斑馬魚胚胎的獨特特性使其對心血管研究特別有吸引力。例如,有一些實用的遺傳干擾方法,如嗎啡寡聚核苷酸注射,以誘導斑馬魚心臟缺陷。這些胚胎是透明的,可以在心臟發育過程中無創成像。在體內,心腔和血管以及血流可以很容易地被觀察到。在發育早期,斑馬魚胚胎不依賴于循環系統,因為被動擴散足以供氧。因此,具有嚴重心臟缺陷的胚胎能夠在早期發育中存活,通過這種方法,我們研究了無血流情況下心臟瓣膜的發育情況,這些研究證明了血流動力學對心臟瓣膜發育的重要影響。隨著正向和反向遺傳學方法的進步,現在有可能在斑馬魚胚胎中誘導各種臨床相關的心臟缺陷。在這些動物模型中,需要對血流動力學進行分析,以研究誘導缺陷的機械生物學機制。對于定性和定量的血流動力學分析,有多種顯微成像和計算建模方法。這些分析包括確定流型、測量流速、計算心功能參數和計算血流動力學應力水平。
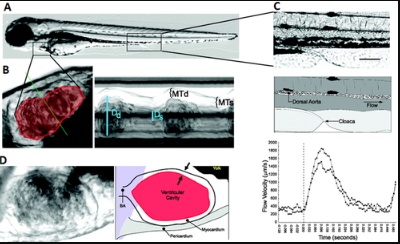
斑馬魚心臟發育:在脊椎動物胚胎中形成并開始運作的第一個器官是心臟。與雙心室哺乳動物心臟不同,成年斑馬魚心臟由一個心室、一個心房、一個房室(AV)瓣膜和一個流出瓣膜組成。脊椎動物之間的遺傳途徑是保守的,斑馬魚的心臟發育過程與其他脊椎動物相似。最早于前外側板中胚層受精后5小時(hpf)的心前細胞開始,并繼續形成原腸,再形成外胚層、內胚層和中胚層。原腸形成在10 hpf時完成,隨后在16 hpf時胚胎中線處的雙側心臟融合。這就形成了一個心錐,然后向前延伸,變成一個線性的心管。線性心導管的外層由收縮肌細胞組成,而內層由心內膜細胞組成。這兩層由一層無細胞的細胞外基質層(稱為心凍)隔開。在其形成后,24 hpf時線性心導管開始有節奏地蠕動收縮。人類的第一次心跳開始于3周,小鼠的第一次心跳開始于(e是胚胎發育日)e8.5,雞的第一次心跳開始于(hh是雞發育期)hh10。隨后階段斑馬魚胚胎的收縮程度可通過高速延時視頻顯微鏡進行量化,以確定心室部分縮短,這是舒張和收縮時心室尺寸的比較。即使在這個階段沒有瓣膜存在,血液仍以250μm/sec的峰值速度泵出,沒有明顯的回流。不久后,管腔開始開放,每博輸出量和心跳迅速上升。在28 hpf時,心跳正常,頻率為2.6 Hz。心臟管在33 hpf處呈S形向左轉,心室移到心房右側。在36 hpf時,泵送機制從緩慢的蠕動波轉變為連續的心室收縮,提示心臟傳導系統的開始。受精后2天,心室室膨脹,內外彎曲明顯。在此階段,心肌細胞開始從心室壁分層,開始形成小梁,到72 hpf時心室有明顯的小梁脊。小梁心肌隨著心肌壁的顯著重塑,以及致密心肌的增殖和傳導系統的成熟而向心室腔擴張。遺傳學篩選研究揭示了斑馬魚這些早期事件的分子調控。與NKx2.5相關的GATA因子通過限制Wnt信號來控制心肌細胞祖細胞的遷移和心臟的調節。Hand2在心臟分化和形態發生中起作用,而Nkx2.5維持了心臟室的特性。最近,心臟收縮和由此產生的液體力量被證明能夠激活Notch信號來調節斑馬魚的心臟小梁。由小葉組成的心臟瓣膜確保斑馬魚單向血流。房室之間的房室管內有一個瓣膜,心室和球動脈之間的流出道內有一個瓣膜。房室瓣膜發育始于心肌中BMP4、TBX2b和VCANA的表達,以及37 hpf時Notch1b、Has2和神經調節蛋白的心內膜表達。血流動力學是斑馬魚AV瓣膜發育的重要機械刺激。例如,KLF2A的表達依賴于反向流動的存在,而剪切應力控制著AV管中MIR-21的差異表達。在40 hpf時,心內膜墊開始轉變為原始瓣葉。心內膜墊重塑為原始瓣葉,以防止76 hpf時完全逆行。此時通過心內膜墊的血流速度約為3.0毫米/秒,最大壁面剪應力(wss)為70dynes/平方厘米。心內膜墊的形成發生在人類4.5周、小鼠e12周和雞hh24周。在流出血管中,動脈球由一層厚的外層平滑肌細胞和一層薄的內層內皮細胞組成。這個小腔體是有彈性的,可以保證高壓的保持,防止主動脈回流。與三葉哺乳動物主動脈瓣相比,流出瓣只有兩個瓣葉。斑馬魚心臟的流量可以通過簡單的追蹤單個紅細胞來測量。或者,為了進行更詳細的流量分析,數字粒子圖像測速(DPIV)可以通過連續幀之間的粒子位置相關性(在大多數情況下為紅細胞熒光)生成空間流量圖。這兩種技術都需要至少每秒150幀(fps)的快速圖像采集。紅細胞或血漿應熒光標記以增強對比度。
斑馬魚的遺傳途徑:盡管胚胎雞在外科/機械干擾研究中被廣泛應用,斑馬魚胚胎卻適合于遺傳干擾。已知斑馬魚基因組序列,成功地將正向/反向遺傳方法應用于斑馬魚胚胎,以確定研究特定基因功能的分子途徑。正向遺傳學是決定一個有機體特定表型的遺傳基礎。另一方面,逆向遺傳學是有選擇地操縱一個先前確定的基因,并分析這種操縱對生物體的影響。對于斑馬魚,通過輻射或化學處理成功地誘導了基于正向遺傳學的隨機突變,并為雜交后代產生了穩定的系。用這種方法產生了數百個心血管發育異常的突變體。舉例來說,通過正向遺傳學篩選確定了導致瓣膜缺陷和主動脈縮窄的幾個突變。正向遺傳學的另一個例子是雙突變系casper。這種突變體沒有黑色素細胞和虹膜細胞,這使得它在整個生命中都是透明的,能夠進行無創成像。斑馬魚胚胎也可以利用幾種反向遺傳技術選擇性地抑制基因功能。最常用的技術是將反義嗎啉寡核苷酸(mos)注入受精卵。mos可以通過靶向轉錄起始位點或靶向剪接連接并誘導異常剪接來抑制翻譯。有效阻止靶基因的蛋白質合成3-5天。由于在斑馬魚中易于利用,mos使基因功能的分析得以廣泛應用。很快就發現一些mos工作得很好,并且有許多mos表型有效地重演突變表型,而沒有任何主要副作用。然而,mos可以誘導p53依賴性細胞凋亡和基因表達中的非靶向細胞特異性效應,這可能影響表型分析。在大量的基因敲除系中,在相應的突變體中,幾乎80%的Mo變形體表型沒有被觀察到,這導致人們質疑Mo在斑馬魚研究中的廣泛應用。有人建議不應過量注射mos以限制靶向效應,必須產生穩定的突變體并對其進行適當的表征,以驗證mo變形劑的表型。斑馬魚最近引進了兩種反向遺傳學的替代技術:TALENs和CRISPR/CAS9。這些技術影響基因組DNA而不是RNA轉錄。因此,它們的分子效應可以在單胚胎水平上確定,以獲得明確的表型/基因型相關性。這些技術的非目標效應可以忽略不計。這些基因方法被用來在斑馬魚胚胎中產生人類心血管疾病,以揭示分子機制。有兩種常見的形式:擴張型心肌病和肥厚型心肌病。對心肌病斑馬魚突變體的正向遺傳篩選顯示,titin、層粘連蛋白α4和整合素連接激酶的突變可導致模擬人類臨床條件的心力衰竭。在一項反向遺傳研究中,在鑒定了DCM患者的Eya4突變后,斑馬魚的Eya4基因通過嗎啡寡聚核苷酸注射被敲除。由此產生的表型具有心肌病,表明在這種情況下Eya4突變的作用。我們的研究小組在肥厚型心肌病患者中發現了肌球蛋白結合蛋白C的幾個突變,并通過嗎啡寡聚核苷酸注射對斑馬魚模型中的這些突變進行了概括。心臟功能分析和血流動力學評估在這些和類似的動物缺陷模型中很重要。下面,我們將解釋這些斑馬魚胚胎的分析技術。
明視野延時圖像序列的心臟功能分析:在斑馬魚發育的早期階段(3-4 dpf),胚胎是透明的,內部器官包括心臟和血液循環都有良好的可視性。因此,在這一階段,視頻明視野顯微鏡可用于心臟功能和形態的定量分析。該方法是基于記錄二維(2D)圖像序列以進一步進行心血管分析。動物處于側位,整個心臟周期內心室清晰可見。在此配置中,中庭不可見。使用自動視頻邊緣檢測系統可以測量心室功能的心肌壁。120-fps視頻捕獲速度足以滿足此應用。收縮壁速度水平在2 dpf時約為200μm/sec,在6 dpf時約為275μm/sec。心室壁運動也可以用類似于M型超聲心動圖的方法進行實際分析。這里的目的是在整個心臟周期中跟蹤心室壁位置的連續變化。通過首先確定感興趣的線性區域來實現。這個區域要么是心室的短軸,要么是心室的長軸。對于M模式圖像,沿這條線的強度值是Y軸,視頻的每一幀在X軸中表示。這樣,心室短軸和長軸直徑的變化可以在整個心臟循環中測量。M型分析可以跟蹤心肌壁厚和心室直徑。舒張和收縮的短軸直徑表示為dd和ds,心肌厚度表示為mtd和mts。圖像以250 fps的速度捕獲,以獲得良好的時間分辨率。測量血流速度以量化斑馬魚胚胎的心血管功能。這可以通過簡單地跟蹤胚胎體內紅細胞(RBC)的運動來實現,紅細胞由于透明的皮膚很容易被識別出來。可以計算紅細胞運動的加速、減速和峰值速度進行分析。紅細胞在兩條通過身體的主血管中的運動,在主動脈背側和主靜脈中,可以成像。
通過光片熒光顯微鏡進行三維實時成像:斑馬魚胚胎心臟的高分辨率成像要求很高,因為其心率為2-4赫茲,相對較大的尺寸約為250μm。因此,斑馬魚心血管系統的體內功能和結構成像需要先進的顯微鏡,該顯微鏡可以記錄高時間和空間R值的光學切片。傳統的共焦激光掃描熒光顯微鏡(CLSM)是基于物體的點掃描。穿透深度也相對較低;因此,捕獲跳動的斑馬魚胚胎心臟是很困難的,尤其是對于較老的胚胎。光片熒光顯微鏡(LSFM)于2004年推出,以消除CLSM的局限性。這種技術被稱為選擇性平面照明顯微鏡(SPIM)。其工作原理是利用薄激光片從側面照射熒光標記的樣品,僅在檢測目標的焦平面激發熒光,同時記錄發射光.LSFM中的檢測系統包括CCD/SCMOS攝像機,而不是像CLSM中那樣的掃描光電倍增管探測器。因此,LSFM提供了幾個重要的優點,包括提高采集速度、高信噪比、低光漂白和大穿透深度。此外,在大多數應用中,樣品被放置在一個專用的垂直支架(透明注射器或毛細管)中,并浸入一個充滿介質的成像室中。將樣品嵌入低濃度瓊脂糖柱中,與傳統的玻璃載玻片相比,低濃度瓊脂糖柱對活的生物樣品來說壓力更小。垂直安裝還可以在不變形的情況下旋轉精密樣品,并方便360°成像。因此,LSFM成為斑馬魚研究的新標準成像方式,因為它能夠在生理成像介質中實現快速和高分辨率的動態成像。LSFM顯著增強了斑馬魚胚胎的心功能分析。心臟內的特定區域現在可以在體內高分辨率成像。然而,為了對心臟進行完整和準確的功能分析,需要對三維重建的心臟跳動圖像進行三維分析。心臟在所有維度上持續快速的運動,使得捕捉這樣高分辨率的圖像變得非常困難。一種解決辦法是像沉默的心臟模型那樣抑制心臟。然而,該模型不適用于研究心臟發育過程中的血流動力學和心臟收縮。另一種方法是使用前瞻性門控技術獲得靜止的3D心臟。當心臟繼續跳動時,它會在成像物鏡的焦平面上緩慢移動。對這些圖像進行三維重建,以在這個特定階段生成心臟模型。不能用這種方法研究心跳的動力學。心臟跳動的動力學只能通過4D成像(3d+時間)進行全面分析,這需要非常快速的圖像采集和深度穿透。采集后同步技術的進步使得在4D中捕捉斑馬魚胚胎心臟跳動的動態成為可能。?在這項技術中,心臟組織的動態運動是通過對圖像疊加的回顧性時間配準來重建的。在整個心臟深度的連續光學截面上,記錄下跳動的心臟的短片。然后,對連續z平面的圖像序列進行回顧性登記,以制作心臟跳動的4D影片。心包細胞、心肌細胞和紅細胞可以被熒光染色,以70–85 fps的速度錄制的3D電影可以用于制作4D電影,實現詳細和動態的心臟功能分析。最近,雙光子激發與LSFM的集成導致穿透深度的增強和光板厚度的保留,從而實現了高采集速度(>70 fps)和低光損傷。為進一步提高掃描速度,已開發出新的方法。一種是多色LSFM。實現混合波長激發,實現快速多色雙光子成像。通過這種方法,分別對CFP、GFP和DSRED標記的心包、心肌和紅細胞進行了模擬成像。快速時間序列圖像以每秒85幀的速度采集,然后用于生成心臟周期運動的4D電影。與單色LSFM相比,該技術沒有產生額外的光損傷。同時對心肌和紅細胞成像可改善動態分析。最后,圖像采集技術的進步使4D電影能夠直接錄制心臟跳動。光片顯微鏡現在可以記錄心肌壁和紅細胞的動態運動;這一進展導致了先進技術的應用,如粒子圖像測速和計算建模,斑馬魚心血管血流動力學分析。
基于數字粒子圖像測速(DPIV)的剪應力分析:WSS是心血管系統中作用于血管壁和瓣葉表面的摩擦力。它是剪切速率(與血管半徑相關的速度導數)和血液動態粘度(流體粘度是其抗應力逐漸變形能力的一種度量)的產物。定量和定性分析心血管系統中的WSS是重要的,因為它的大小和方向都被認為有助于心臟發生。有重要證據表明,心血管內皮細胞上的WSS可顯著影響血管和瓣膜的發育,以及成人有機體血管和瓣膜疾病的發病機制。具有不同流體力學特性(即穩定與不穩定、層流與湍流、順行與振蕩)的流動顯示出對內皮細胞中特定基因表達途徑的不同調節。因此,準確測定剪切應力模式和剪切應力水平對于心血管疾病的臨床和體內研究具有重要意義。由于WSS與容器壁的軸向速度梯度成正比,因此應確定該位置的速度梯度來計算WSS。然而,由于以下幾個原因,這不是一項容易的任務:復雜的幾何結構、不穩定的脈沖流行為、移動的邊界(即血管壁和瓣膜傳單)和血液的非牛頓行為(血液粘度隨剪切速率的變化、剪切減薄特性)。因此,對于WSS計算,通常采用簡化假設,如理想幾何、穩定流、簡單拋物線速度剖面、牛頓行為等,但這些都會導致不可靠的結果。DPIV已成為體內研究確定心血管系統中速度向量和WSS水平的有力工具。對于像斑馬魚心血管流這樣的小幾何體,DPIV需要對流場進行微觀分析。在這里,示蹤粒子的直徑非常重要,因此這些顆粒應足夠大,能夠單獨識別,同時又足夠小,能夠跟隨局部流動。對于斑馬魚血流量的DPIV,可以跟蹤紅細胞或注射珠。在Hove等人的開創性研究中,通過追蹤紅細胞來測定速度和WSS水平。
通過計算流體動力學(CFD)進行血流動力學分析:CFD模型在心血管研究中非常有利于研究復雜的流體行為,實驗測量只能提供有限的信息。CFD模型也被用于體內研究,目的是研究發育中心臟的血流動力學。為此,胚胎雛雞模型得到了廣泛的應用。斑馬魚是另一種常用于心血管研究的動物模型。以前的研究表明,與其他動物系統相似,機械信號有助于斑馬魚心臟的發育。更具體地說,流體剪切應力和跨壁壓力通過觸發內皮細胞內的機械生物學機制來影響血管、腔和瓣膜的形態形成。通過發育中的心臟的血流受到干擾,導致心臟發育改變,與人類冠心病相似。然而,有趣的是,對于斑馬魚模型的詳細血流動力學研究,目前還缺乏CFD研究。在一項研究中,針對一個簡化的心臟幾何結構(近似于4.5 dpf斑馬魚心臟)開發了一個二維CFD模型。模型是一個線性通道,兩個交錯的心室從通道的對側凸出,代表心房和心室。心內膜墊存在于流入道、AV管和流出道的背側和腹側。?采用兩種不同的方法進行血流模擬:第一種方法是通過剛性幾何體在入口邊界定義速度入口條件。在第二種方法中,心房和心室被定義為彈性材料,收縮的心房強制血流,收縮的心房彈性地伸展心室。通過求解控制流體流動方程,得到了作用于壁面和心內膜墊上的速度流線圖和WSS值。對流線型的分析表明,應考慮移動邊界以準確捕捉流型。在剛性模型中,室壁最大法向應力為0.02 dynes/cm2,心內膜墊最大WSS為2 dynes/cm2。不同心內膜墊高度的模擬顯示,這些墊的發育顯著影響心臟內的WSS分布和大小,以及室壁壓力水平。最高的WSS位于緩沖墊上,隨著高度的增加,WSS也會增加。由于狹窄的房室通道具有更高的流動阻力,隨著墊層高度的增加,室壁上的法向壓力也顯著增加。在隨后的研究中,將斑馬魚血流動力學邊界建模方法應用于基于真實幾何的CFD模型。采用轉基因斑馬魚胚胎,其中含有綠色熒光蛋白標記的內皮/心內膜細胞和GATA1標記的紅細胞。GFP標記可以跟蹤管腔壁的邊界,而GATA1標記可以跟蹤血流(通過DPIV),因此可以測量血流速度。斑馬魚胚胎在20-30 hpf到110-120 hpf階段被納入研究。使用熒光顯微鏡收集20 fps時胚胎心臟的二維圖像。在每幅圖像中,通過追蹤熒光內皮細胞來確定管腔邊界。建立了一種實用的方法來估計斑馬魚心臟中的WSS水平。該方法將活體共焦成像與CFD相結合,并基于從心壁動力學(而不是直接從紅細胞運動)估算WSS水平。本研究使用48-hpf斑馬魚胚胎。在120 fps下對GATA1-DSRED標記的RBC進行實時成像,以生成4D心臟視圖。在這個二維幾何體上,定義了流體動力中心線,為心臟解剖提供了一維參數化。這些工作表明了計算流體動力學在斑馬魚血流動力學分析中的重要性,但為了更好地理解心臟發育的機理,還需要做更多的工作。計算機模型需要在3D中開發,并且必須結合壁動力學和流體動力學(流體-結構相互作用方法)進行精確分析。
結論:在過去的幾十年里,斑馬魚模型已經發展成為一個非常強大的模型來研究心臟發育。正向和反向遺傳干擾技術的進步使得在這些動物身上誘導人類心血管缺陷成為可能。心血管動力學已經在這些疾病模型中進行了研究,最常見的是通過基本的2D 明視野顯微鏡分析,該分析涉及心臟功能計算的誤差。光片熒光顯微鏡是專門為斑馬魚胚胎研制的。這些顯微鏡可以實時跟蹤心肌壁和紅細胞的運動。因此,現在可以用這些顯微鏡制作4D跳動的斑馬魚心臟電影。通過LSFM快速獲取圖像,使得將DPIV和計算建模等先進技術應用于斑馬魚研究成為可能。然而,由于斑馬魚心臟小尺寸和快速移動邊界的成像和建模困難,目前大多數研究涉及二維心臟平面的血流動力學分析。開發具有不同平面同步圖像采集工作原理的三維微DPIV系統將有助于斑馬魚心臟在三維中的直接和快速可視化。超聲生物顯微鏡和光學相干斷層掃描系統已成功應用于其他胚胎動物系統,以及成年斑馬魚。這些是胚胎斑馬魚成像的潛在非常有用的方式。由于體型非常小,目前的商業系統不適合斑馬魚胚胎。我們希望在不久的將來能開發出新的探針來成像胚胎斑馬魚。根據CFD建模,未來的模型應基于流體-結構相互作用方法,將壁動力學和血流動力學結合起來。整合技術來產生斑馬魚的缺陷模型,將為研究者打開新的視野。




 17312606166
17312606166